


Cogemos una flor (uñas de gatos). Le extraemos los pétalos y a continuación en un mortero mezclamos arena, alcohol y los pétalos extraídos de la flor de uñas de gato y posteriormente se trituran hasta mezclar bien las tres sustancias. El líquido se introduce en el cono centrifugo para posteriormente introducirlo en la centrifugadora para separar las sustancias líquidas de las sólidas.
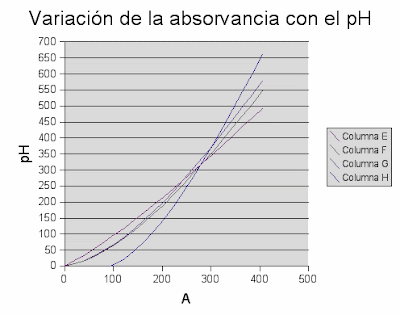
Con este líquido pretendemos estudiar la variación de color con respecto al pH de la sustancia.Para variar el pH de la sustancia mezclamos el líquido obtenido de los pétalos con diferentes sustancias. Los resultados obtenidos por el estudio de la variacion del pH son los obtenidos.
Realizado por:
-Alfonso Muñoz Baena
-Juan Pérez Páez
-Alejandro Quirós Muñoz





.jpg)







